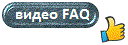|
ąźąŠą╗ą╝ą░ąĮčüą║ąĖą╣ ąÉ. ąĪ. ŌĆō
ą×čüąŠą▒ąĄąĮąĮąŠčüčéąĖ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖą║ąĖ ą▓ąŠą┤čŗ ąĖ ą▒ąĖąŠčŹąĮąĄčĆą│ąĄčéąĖą║ą░
ąŻąöąÜ
556.013 + 581.1
ą×ąĪą×ąæąĢąØąØą×ąĪąóąś
ąóąĢąĀą£ą×ąöąśąØąÉą£ąśąÜąś ąÆą×ąöą½ ąś ąæąśą×ąŁąØąĢąĀąōąĢąóąśąÜąÉ
(asholman@mtu-net. ru)
ąÆčüąĄčĆąŠčüčüąĖą╣čüą║ąĖą╣
ąĮą░čāčćąĮąŠ-ąĖčüčüą╗ąĄą┤ąŠą▓ą░č鹥ą╗čīčüą║ąĖą╣ ąĖąĮčüčéąĖčéčāčé 菹╗ąĄą║čéčĆąĖčäąĖą║ą░čåąĖąĖ čüąĄą╗čīčüą║ąŠą│ąŠ
čģąŠąĘčÅą╣čüčéą▓ą░, ą£ąŠčüą║ą▓ą░, ąĀąŠčüčüąĖčÅ
ą£ąŠą╗ąĄą║čāą╗ą░ ą▓ąŠą┤čŗ, ąĄąĄ ą┐čĆąŠč鹊ąĮ ąĖ ą│ąĖą┤čĆąŠą║čüąĖą╗
ąĖą│čĆą░čÄčé ą║ą╗čÄč湥ą▓čāčÄ čĆąŠą╗čī ą▓ 菹ĮąĄčĆą│ąĄčéąĖą║ąĄ ą╝ąĄčéą░ą▒ąŠą╗ąĖąĘą╝ą░. ąØąĄ ą╝ąĄąĮąĄąĄ ą▓ą░ąČąĮčŗ ą┤ą╗čÅ
ą▒ąĖąŠčŹąĮąĄčĆą│ąĄčéąĖą║ąĖ ąĮą░ą┤ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗąĄ ąĖ ą║ąŠąŠą┐ąĄčĆą░čéąĖą▓ąĮčŗąĄ čüą▓ąŠą╣čüčéą▓ą░ ą▓ąŠą┤čŗ.
ą¤ąŠčüą╗ąĄą┤ąĮąĖąĄ, ą┐čĆąŠčÅą▓ą╗čÅčÅčüčī ą▓ ą░ąĮąŠą╝ą░ą╗ąĖčÅčģ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖčģ čüą▓ąŠą╣čüčéą▓ čüą░ą╝ąŠą╣
ą▓ąŠą┤čŗ [1, 2], ą┐ąŠ-ą▓ąĖą┤ąĖą╝ąŠą╝čā, ą╗ąĄąČą░čé ą▓ ąŠčüąĮąŠą▓ąĄ ą╝ąĄčģą░ąĮąĖąĘą╝ą░ ą░ą┤ą░ą┐čéą░čåąĖąĖ ąČąĖą▓čŗčģ
čüąĖčüč鹥ą╝ (čĆą░čüč鹥ąĮąĖčÅ, ąČąĖą▓ąŠčéąĮčŗąĄ) ą║ čāčüą╗ąŠą▓ąĖčÅą╝ ąŠą║čĆčāąČą░čÄčēąĄą╣ čüčĆąĄą┤čŗ. ąŚą░ą▓ąĖčüąĖą╝ąŠčüčéčī
菹ĮąĄčĆą│ąŠąĖąĮč乊čĆą╝ą░čåąĖąŠąĮąĮąŠą│ąŠ ąŠą▒ą╝ąĄąĮą░ ąČąĖą▓čŗčģ čüąĖčüč鹥ą╝ čü ą▓ąĮąĄčłąĮąĄą╣ čüčĆąĄą┤ąŠą╣ ąŠčé
ąŠčüąŠą▒ąĄąĮąĮąŠčüč鹥ą╣ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖą║ąĖ ą▓ąŠą┤čŗ ąŠą▒ąĮą░čĆčāąČąĖą▓ą░ąĄčéčüčÅ ą▓ čéą░ą║ąĖčģ čÅą▓ą╗ąĄąĮąĖčÅčģ ą║ą░ą║
čÅčĆąŠą▓ąĖąĘą░čåąĖčÅ ąĖ čüčéčĆą░čéąĖčäąĖą║ą░čåąĖčÅ. ąśčüą║čāčüčüčéą▓ąĄąĮąĮą░čÅ čüčéčĆą░čéąĖčäąĖą║ą░čåąĖčÅ čŹčäč乥ą║čéąĖą▓ąĮą░ ą▓
čāčüą╗ąŠą▓ąĖčÅčģ ą┐ąŠą▓čŗčłąĄąĮąĮąŠą╣ ą▓ą╗ą░ąČąĮąŠčüčéąĖ ąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ 3 ŌĆō 5ąŠąĪ. ąØąŠ
ąĖą╝ąĄąĮąĮąŠ ą▓ čŹč鹊ą╝ ą┤ąĖą░ą┐ą░ąĘąŠąĮąĄ (4ąŠąĪ) ą▓ąŠą┤ą░ ąĖą╝ąĄąĄčé ą░ąĮąŠą╝ą░ą╗ąĖčÄ
ą┐ą╗ąŠčéąĮąŠčüčéąĖ ąĖ ą╝ąŠą╗čÅčĆąĮąŠą│ąŠ ąŠą▒čŖąĄą╝ą░. ąĪ ą░ąĮąŠą╝ą░ą╗ąĖąĄą╣ ąĖąĘąŠą▒ą░čĆąĮąŠą╣ č鹥ą┐ą╗ąŠąĄą╝ą║ąŠčüčéąĖ,
ąĖą╝ąĄčÄčēąĄą╣ ą╝ąĖąĮąĖą╝čāą╝ ą┐čĆąĖ ~35ąŠąĪ, čüą▓čÅąĘčŗą▓ą░čÄčé ąŠą┐čéąĖą╝ąĖąĘą░čåąĖčÄ ą┐čĆąĖ 35 ŌĆō
37ąŠąĪ 菹ĮąĄčĆą│ąĄčéąĖą║ąĖ ą╝ąĄčéą░ą▒ąŠą╗ąĖąĘą╝ą░ č鹥ą┐ą╗ąŠą║čĆąŠą▓ąĮčŗčģ ąŠčĆą│ą░ąĮąĖąĘą╝ąŠą▓.
ąŚąĮą░čćąĖą╝čŗą╝ąĖ ą┤ą╗čÅ ą▒ąĖąŠčŹąĮąĄčĆą│ąĄčéąĖą║ąĖ ą╝ąŠą│čāčé ąŠą║ą░ąĘą░čéčīčüčÅ ą░ąĮąŠą╝ą░ą╗ąĖąĖ ąĖ ą┤čĆčāą│ąĖčģ
čüą▓ąŠą╣čüčéą▓ ą▓ąŠą┤čŗ, č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮčŗąĄ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ ą║ąŠč鹊čĆčŗčģ ąĖą╝ąĄčÄčé ąĘąĮą░č湥ąĮąĖčÅ
ą║čĆąĖčéąĖč湥čüą║ąŠą╣ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ ą▓ ą┤ąĖą░ą┐ą░ąĘąŠąĮąĄ ąŠčé ~10 ą┤ąŠ 75ąŠąĪ [2].
ąöą╗čÅ ą▓ąŠą┤čŗ čģą░čĆą░ą║č鹥čĆąĮąŠ ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖąĄ ąĘą░
čüč湥čé ą▓ąŠą┤ąŠčĆąŠą┤ąĮčŗčģ čüą▓čÅąĘąĄą╣ (ąØ-čüą▓čÅąĘąĖ) ąĮą░ą┤ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ ą┤ąĖąĮą░ą╝ąĖčćąĮčŗčģ čüčéčĆčāą║čéčāčĆ
ŌĆō ą║ą╗ą░čüč鹥čĆąŠą▓ čü čģą░čĆą░ą║č鹥čĆąĮčŗą╝ ą▓čĆąĄą╝ąĄąĮąĄą╝ ą┐ąĄčĆąĄčüčéčĆąŠą╣ą║ąĖ ą┐ąŠčĆčÅą┤ą║ą░ 10ŌĆō10
ŌĆō 10ŌĆō11 čü. ąóąĄčĆą╝ąŠą┤ąĖąĮą░ą╝ąĖą║ą░ ą║ą╗ą░čüč鹥čĆąĮčŗčģ čüčéčĆčāą║čéčāčĆ ą╝ąŠąČąĄčé
ą▓ąĮąŠčüąĖčéčī čüą▓ąŠčÄ ą╗ąĄą┐čéčā ą▓ ą┐čĆąŠčåąĄčüčü čüą░ą╝ąŠąŠčĆą│ą░ąĮąĖąĘą░čåąĖąĖ ąČąĖą▓čŗčģ čüąĖčüč鹥ą╝.
ąĀą░ą▓ąĮąŠą▓ąĄčüąĖąĄ ąĖ ą║ąĖąĮąĄčéąĖą║ą░ ą┐ąĄčĆąĄčģąŠą┤ąŠą▓ ą╝ąĄąČą┤čā ą║ą╗ą░čüč鹥čĆą░ą╝ąĖ, ą▓ ą┐čĆąĖąĮčåąĖą┐ąĄ,
ą┤ąŠą╗ąČąĮčŗ ą┐ąŠą┤čćąĖąĮčÅčéčīčüčÅ ąĖąĘą▓ąĄčüčéąĮčŗą╝ ąĘą░ą║ąŠąĮą░ą╝ čģąĖą╝ąĖč湥čüą║ąŠą╣ ą║ąĖąĮąĄčéąĖą║ąĖ. ąÜąŠąĮčüčéą░ąĮčéčŗ
čĆąĄą░ą║čåąĖą╣ ąĖ 菹ĮąĄčĆą│ąĖąĖ ąĖčģ ą░ą║čéąĖą▓ą░čåąĖą╣ ą╝ąŠą│čāčé ą┤ą░čéčī ąĖąĮč乊čĆą╝ą░čåąĖčÄ ąŠ čüą┐ąĄčåąĖčäąĖą║ąĄ
ą╝ąĄčģą░ąĮąĖąĘą╝ą░ ąĮą░ą┤ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ ąŠčĆą│ą░ąĮąĖąĘą░čåąĖąĖ ą╝ąŠą╗ąĄą║čāą╗ ą▓ąŠą┤čŗ, ąŠčéą▓ąĄčéčüčéą▓ąĄąĮąĮąŠą│ąŠ
ąĘą░ čéčā ąĖą╗ąĖ ąĖąĮčāčÄ ą░ąĮąŠą╝ą░ą╗ąĖčÄ ąĄąĄ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖčģ čüą▓ąŠą╣čüčéą▓. ąÜąĖąĮąĄčéąĖč湥čüą║ąĖąĄ
čģą░čĆą░ą║č鹥čĆąĖčüčéąĖą║ąĖ ą┐čĆąŠčåąĄčüčüąŠą▓ ą▓ ą▓ąŠą┤ąĄ ą╝ąŠąČąĮąŠ ąŠą┐čĆąĄą┤ąĄą╗ąĖčéčī ąĖąĘ ą░ąĮą░ą╗ąĖąĘą░ ą╗ąĖąĮąĄą╣ąĮčŗčģ
ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖą╣ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮčŗčģ ąĘą░ą▓ąĖčüąĖą╝ąŠčüč鹥ą╣ ąĄąĄ čüą▓ąŠą╣čüčéą▓. ąöąŠą┐ąŠą╗ąĮąĖč鹥ą╗čīąĮčāčÄ
ąĖąĮč乊čĆą╝ą░čåąĖčÄ ąŠ čüą▓ąŠą╣čüčéą▓ą░čģ ąĮą░ą┤ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ čüčéčĆčāą║čéčāčĆ ą▓ąŠą┤čŗ ą┤ą░čÄčé
ąĖčüčüą╗ąĄą┤ąŠą▓ą░ąĮąĖčÅ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ ąŠą┐čéąĖč湥čüą║ąŠą╣ ą░ą║čéąĖą▓ąĮąŠčüčéąĖ čäąĖąĘąĖąŠą╗ąŠą│ąĖč湥čüą║ąĖčģ
ąČąĖą┤ą║ąŠčüč鹥ą╣ ąŠčé ąĖčģ čüąŠčüčéą░ą▓ą░ ąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ.
ąĪ čŹč鹊ą╣ čåąĄą╗čīčÄ ą▓ ąĮą░čüč鹊čÅčēąĄą╣ čĆą░ą▒ąŠč鹥
ą┐čĆąŠą░ąĮą░ą╗ąĖąĘąĖčĆąŠą▓ą░ąĮčŗ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮčŗąĄ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ ąŠčüąĮąŠą▓ąĮčŗčģ čüą▓ąŠą╣čüčéą▓ ąČąĖą┤ą║ąŠą╣
ą▓ąŠą┤čŗ ąĖ ąĖčüčüą╗ąĄą┤ąŠą▓ą░ąĮąŠ ą▓ą╗ąĖčÅąĮąĖąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ ąĮą░ ą▓ąĄą╗ąĖčćąĖąĮčā ąŠą┐čéąĖč湥čüą║ąŠą╣
ą░ą║čéąĖą▓ąĮąŠčüčéąĖ čäąĖąĘąĖąŠą╗ąŠą│ąĖč湥čüą║ąĖčģ čĆą░čüčéą▓ąŠčĆąŠą▓, čüąŠą┤ąĄčƹȹ░čēąĖčģ ąŠą┐čéąĖč湥čüą║ąĖ ą░ą║čéąĖą▓ąĮčŗąĄ
(čģąĖčĆą░ą╗čīąĮčŗąĄ) ą╝ąĄčéą░ą▒ąŠą╗ąĖčéčŗ (čüą░čģą░čĆ, ą░ą╝ąĖąĮąŠą║ąĖčüą╗ąŠčéčŗ).
ą£ąĄč鹊ą┤ąĖą║ą░
ąŁą║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮčŗąĄ ą┤ą░ąĮąĮčŗąĄ ą┐ąŠ
č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖą╝ čüą▓ąŠą╣čüčéą▓ą░ą╝ ą▓ąŠą┤čŗ ą▓ąĘčÅą╗ąĖ ąĖąĘ ąĖčüč鹊čćąĮąĖą║ąŠą▓: ą┐ą╗ąŠčéąĮąŠčüčéčī (ρ)
[3], ą┤ąĖąĮą░ą╝ąĖč湥čüą║ą░čÅ ą▓čÅąĘą║ąŠčüčéčī (η) [4], ąĖąĘąŠą▒ą░čĆąĮą░čÅ č鹥ą┐ą╗ąŠąĄą╝ą║ąŠčüčéčī (ąĪčĆ)
[2], čüąČąĖą╝ą░ąĄą╝ąŠčüčéčī (γ) [2], čüą║ąŠčĆąŠčüčéčī ąĘą▓čāą║ą░ (v)
[3], ą╝ąŠą╗čÅčĆąĮčŗą╣ ąŠą▒čŖąĄą╝ (V) [2] ąĖ
ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĮąŠąĄ ąĮą░čéčÅąČąĄąĮąĖąĄ (σ) [5]. ąśčüą┐ąŠą╗čīąĘąŠą▓ą░ą╗ąĖ ą┐ąŠą╗čÅčĆąĖą╝ąĄčéčĆ ą║čĆčāą│ąŠą▓ąŠą╣
ąĪą£-ąŚ čü ąĮą░čéčĆąĖąĄą▓ąŠą╣ ą╗ą░ą╝ą┐ąŠą╣ (č鹊čćąĮąŠčüčéčī ąĖąĘą╝ąĄčĆąĄąĮąĖčÅ 0,01ąŠ, ą┤ą╗ąĖąĮą░
ą▓ąŠą╗ąĮčŗ D-ą╗ąĖąĮąĖąĖ ąĮą░čéčĆąĖčÅ ŌĆō 589 ąĮą╝) ąĖ ą║čÄą▓ąĄčéčŗ
ą┤ą╗ąĖąĮąŠą╣ 200 ąĖ 100 ą╝ą╝. ąÜąŠąĮčåąĄąĮčéčĆą░čåąĖąĖ čäąĖąĘąĖąŠą╗ąŠą│ąĖč湥čüą║ąĖčģ čĆą░čüčéą▓ąŠčĆąŠą▓
čüąŠą┤ąĄčƹȹ░čēąĖčģ ąČąĄą╗ą░čéąĖąĮ ąĖ čüą░čģą░čĆ ą┐ąŠą┤ą▒ąĖčĆą░ą╗ąĖ ąĖąĘ čāčüą╗ąŠą▓ąĖčÅ čüąŠčģčĆą░ąĮąĄąĮąĖčÅ
ą┤ąŠčüčéą░č鹊čćąĮąŠą╣ ą┐čĆąŠąĘčĆą░čćąĮąŠčüčéąĖ ąČąĖą┤ą║ąŠčüč鹥ą╣. ąöą╗čÅ ą┐čĆąĖą│ąŠč鹊ą▓ą╗ąĄąĮąĖčÅ čĆą░čüčéą▓ąŠčĆąŠą▓
ąĖčüą┐ąŠą╗čīąĘąŠą▓ą░ą╗ąĖ čüčéą░ąĮą┤ą░čĆčéąĮčŗą╣, ąĖąĘąŠč鹊ąĮąĖč湥čüą║ąĖą╣ čäąĖąĘčĆą░čüčéą▓ąŠčĆ (0,9 %
NaCl). ąĪą░čģą░čĆ ąĖ ąČąĄą╗ą░čéąĖąĮ ą▒čĆą░ą╗ąĖ ą┐ąĖčēąĄą▓ąŠą╣.
ąĀąĄąĘčāą╗čīčéą░čéčŗ ąĖ ąŠą▒čüčāąČą┤ąĄąĮąĖąĄ
ąøąĖąĮąĄą╣ąĮčŗąĄ ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ
č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮčŗčģ ąĘą░ą▓ąĖčüąĖą╝ąŠčüč鹥ą╣ ą┐ą╗ąŠčéąĮąŠčüčéąĖ, ą╝ąŠą╗čÅčĆąĮąŠą│ąŠ ąŠą▒čŖąĄą╝ą░ ąĖ
č鹥ą┐ą╗ąŠąĄą╝ą║ąŠčüčéąĖ, ą┤ąĖąĮą░ą╝ąĖč湥čüą║ąŠą╣ ą▓čÅąĘą║ąŠčüčéąĖ ąĖ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĮąŠą│ąŠ ąĮą░čéčÅąČąĄąĮąĖčÅ
ą┐čĆąĖą▓ąĄą┤ąĄąĮčŗ ąĮą░ ąĀąĖčü 1, 2, ą░ ąĖčģ ą║ąŠąĮčüčéą░ąĮčéčŗ ąĖ 菹ĮąĄčĆą│ąĖąĖ ą░ą║čéąĖą▓ą░čåąĖąĖ ą▓ ąóą░ą▒ą╗ąĖčåąĄ.
ąŚą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ čāą│ą╗ą░ ą▓čĆą░čēąĄąĮąĖčÅ čĆą░čüčéą▓ąŠčĆąŠą▓ ąōąÜ, ąČąĄą╗ą░čéąĖąĮą░ ąĖ čüą░čģą░čĆą░ ą▓ąŠ ą▓čĆąĄą╝ąĄąĮąĖ
ąĖ ąŠčé č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ ą┐čĆąĖą▓ąĄą┤ąĄąĮčŗ ąĮą░ ąĀąĖčü 3.
ąÉą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ ą┤ą╗čÅ
čüąČąĖą╝ą░ąĄą╝ąŠčüčéąĖ, čüą║ąŠčĆąŠčüčéąĖ ąĘą▓čāą║ą░ ąĖ ąĖąĘąŠą▒ą░čĆąĮąŠą╣ č鹥ą┐ą╗ąŠąĄą╝ą║ąŠčüčéąĖ ą▒čŗą╗ąĖ ą┐ąŠą┤ąŠą▒ąĮčŗ
ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ ą┐ą╗ąŠčéąĮąŠčüčéąĖ, ąŠčéą╗ąĖčćą░čÅčüčī ą╗ąĖčłčī ąĘąĮą░č湥ąĮąĖčÅą╝ąĖ ą║ąŠąĮčüčéą░ąĮčé ąĖ
ą║čĆąĖčéąĖč湥čüą║ąŠą╣ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ (ąóą║čĆ). ąøąĖąĮąĄą╣ąĮčŗąĄ ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ
č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮčŗčģ ąĘą░ą▓ąĖčüąĖą╝ąŠčüč鹥ą╣ ą░ą▒čüąŠą╗čÄčéąĮčŗčģ (∆ąÉ = |ąÉ ŌĆō ąÉą║čĆ|)
ąĖą╗ąĖ ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮčŗčģ ąĖąĘą╝ąĄąĮąĄąĮąĖą╣ (∆ąÉ/ąÉą║čĆ) (ąÉ =
ρ, ąĪčĆ, γ, v,
V; ąÉą║čĆ
ŌĆō ąÉ ą┐čĆąĖ ąóą║čĆ) ąĖą╝ąĄą╗ąĖ ąŠą┤ąĖąĮą░ą║ąŠą▓čŗą╣ ą▓ąĖą┤:
(∆ąÉ)1/2 =
tg α
(1/ąó ŌĆō 1/ąóą║čĆ), (1)
ą│ą┤ąĄ,
tg α
ŌĆō čéą░ąĮą│ąĄąĮčü čāą│ą╗ą░ ąĮą░ą║ą╗ąŠąĮą░ čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĄą╣ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ. ąśąĘ č乊čĆą╝čāą╗čŗ (1)
čüą╗ąĄą┤čāąĄčé ąŠą▒čēąĖą╣ ą▓ąĖą┤ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ ą┤ą╗čÅ ą░ą▒čüąŠą╗čÄčéąĮčŗčģ ąĖ ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮčŗčģ
ąĖąĘą╝ąĄąĮąĄąĮąĖą╣ ąÉ:
∆ąÉ (∆ąÉ/ąÉą║čĆ) =
ąÆ (∆ąó/ąó)2, (2)
ą│ą┤ąĄ ∆ąó = |ąó ŌĆö ąóą║čĆ|,
ą░ ąÆ = (tg
α /ąóą║čĆ)2.
ąÉą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ ąĖąĘą╝ąĄąĮąĄąĮąĖą╣ ą┐ą╗ąŠčéąĮąŠčüčéąĖ ąĖ
ą╝ąŠą╗čÅčĆąĮąŠą│ąŠ ąŠą▒čŖąĄą╝ą░ ąĮąĖąČąĄ ąĖ ą▓čŗčłąĄ ąóą║čĆ ąĖą╝ąĄą╗ąĖ ąŠą┤ąĖąĮą░ą║ąŠą▓čŗąĄ
ąĘąĮą░č湥ąĮąĖčÅ tg α, č鹊ą│ą┤ą░ ą║ą░ą║
tg α ąĖ ąÆ ą┤ą╗čÅ čüąČąĖą╝ą░ąĄą╝ąŠčüčéąĖ, č鹥ą┐ą╗ąŠąĄą╝ą║ąŠčüčéąĖ ąĖ
čüą║ąŠčĆąŠčüčéąĖ ąĘą▓čāą║ą░ čĆą░ąĘą╗ąĖčćą░ą╗ąĖčüčī ą┤ą╗čÅ ąó < ąóą║čĆ (ąÆŌĆō) ąĖ
ąó > ąóą║čĆ (ąÆ+).
ąĀąĖčü. 1.
ąÉą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ ą░ą▒čüąŠą╗čÄčéąĮčŗčģ (1) ąĖ ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮčŗčģ ąĖąĘą╝ąĄąĮąĄąĮąĖą╣ (3) ą┐ą╗ąŠčéąĮąŠčüčéąĖ
ąĖ ą╝ąŠą╗čÅčĆąĮąŠą│ąŠ ąŠą▒čŖąĄą╝ą░ (2)
ąóą░ą▒ą╗ąĖčåą░1
ąÜą×ąØąĪąóąÉąØąóą½ ąøąśąØąĢąÖąØą½ąź
ąÉą¤ą¤ąĀą×ąÜąĪąśą£ąÉą”ąśąÖ ąóąĢą£ą¤ąĢąĀąÉąóąŻąĀąØą½ąź
ąśąŚą£ąĢąØąĢąØąśąÖ ąĪąÆą×ąÖąĪąóąÆ ąÆą×ąöą½
|
ąźą░čĆą░ą║č鹥čĆąĖčüčéąĖą║ą░
(ąÉ) |
ąöąĖą░ą┐ą░ąĘąŠąĮ
ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ
∆t
ąĖ (tą║čĆ) (ąŠąĪ) |
ąĢą░
(ą║ąöąČ/ą╝ąŠą╗čī) |
tg
α |
ąÆ
|
|
ą¤ą╗ąŠčéąĮąŠčüčéčī
(∆ρ) |
0 ŌĆö 25
(4) |
0 |
(2,16 ┬▒
0,02)102 |
0,61 |
|
ąśąĘąŠą▒ą░čĆąĮą░čÅ
č鹥ą┐ą╗ąŠąĄą╝ą║ąŠčüčéčī
(∆ąĪčĆ/ąĪą║čĆ) |
0 ŌĆō 80
(35) |
0 |
(2,5 ┬▒
0,1)102
(1,9 ┬▒
0,1)102 |
ąÆŌĆō
= 0,66
ąÆ+
= 0,38
|
|
ąĪąČąĖą╝ą░ąĄą╝ąŠčüčéčī
(∆γ) |
0 ŌĆō 100
(45) |
0 |
(5,0 ┬▒
0,1)106
(4,6 ┬▒
0,1)106 |
ąÆŌĆō
= 2,47 108
ąÆ+
= 2,09 108 |
|
ą£ąŠą╗čÅčĆąĮčŗą╣
ąŠą▒čŖąĄą╝ (∆V) |
0 ŌĆō 90
(4) |
0 |
(9,2 ┬▒
0,1)102 |
11,0 |
|
ąĪą║ąŠčĆąŠčüčéčī
ąĘą▓čāą║ą░
(∆v) |
0 ŌĆō 100
(75) |
0 |
(1,63 ┬▒
0,03)104
(1,74 ┬▒
0,03)104 |
ąÆŌĆō
= 2,2 103
ąÆ+
= 2,5 103 |
|
ąöąĖąĮą░ą╝ąĖč湥čüą║ą░čÅ
ą▓čÅąĘą║ąŠčüčéčī
(η/ηąŠ) |
0 ŌĆō 45
(~22) |
19,0
15,0 |
(2,3 ┬▒
0,1)103
(1,8 ┬▒
0,1)103 |
ŌĆō |
|
ą¤ąŠą▓ąĄčĆčģąĮąŠčüčéąĮąŠąĄ
ąØą░čéčÅąČąĄąĮąĖąĄ
(σ/σąŠ) |
0.01 ŌĆō 80
(~13) |
0,06 ŌĆō
0,6 |
(4,1 ┬▒
0,1) 102 |
2,56 |
ąÆ čüąĖą╗čā ą╝ą░ą╗ąŠčüčéąĖ ą▓ąĄą╗ąĖčćąĖąĮčŗ
Δρ ą╗ąŠą│ą░čĆąĖčäą╝ąĖč湥čüą║ą░čÅ
ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖčÅ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ ą┐ą╗ąŠčéąĮąŠčüčéąĖ ąŠčé ąŠą▒čĆą░čéąĮąŠą╣ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ čéą░ą║ąČąĄ
ą▒čāą┤ąĄčé ą▒ą╗ąĖąĘą║ą░ ą║ ą╗ąĖąĮąĄą╣ąĮąŠą╣, ą┐ąŠčüą║ąŠą╗čīą║čā
[ln (ρ/ρą║čĆ)]1/2
= [ln (1 ┬▒ ∆ρ/ρą║čĆ)]
1/2 ≈ [∆ρ/ρą║čĆ]1/2.
(3)
ą×ą┤ąĮą░ą║ąŠ ą▓ ąŠą║čĆąĄčüčéąĮąŠčüčéąĖ č鹊čćą║ąĖ 1/ąóą║čĆ
ą╗ąĖąĮąĄą╣ąĮąŠčüčéčī (3) ąĮą░čĆčāčłą░ąĄčéčüčÅ (ąĀąĖčü 1), čćč鹊 ąĖ čüą▓ąĖą┤ąĄč鹥ą╗čīčüčéą▓čāąĄčé ąŠ
ąĮąĄą┐čĆą░ą▓ąŠą╝ąŠčćąĮąŠčüčéąĖ ą╗ąŠą│ą░čĆąĖčäą╝ąĖč湥čüą║ąŠą╣ ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ ą▓ ą┤ą░ąĮąĮąŠą╝ čüą╗čāčćą░ąĄ.
ą×čéą╝ąĄčéąĖą╝, čćč鹊
č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮą░čÅ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéčī ą┐ą╗ąŠčéąĮąŠčüčéąĖ čĆčéčāčéąĖ [3] ą▓ ąŠčéą╗ąĖčćąĖąĄ ąŠčé ą┐ą╗ąŠčéąĮąŠčüčéąĖ
ą▓ąŠą┤čŗ ąŠčüčéą░ąĄčéčüčÅ ąĮąĄą╗ąĖąĮąĄą╣ąĮąŠą╣ ą┐čĆąĖ ąŠą▒ąŠąĖčģ čüą┐ąŠčüąŠą▒ą░čģ ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ.
ąĀąĖčü 2.
ąÉą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ ąŠčéąĮąŠčüąĖč鹥ą╗čīąĮčŗčģ ąĖąĘą╝ąĄąĮąĄąĮąĖą╣ ą┤ąĖąĮą░ą╝ąĖč湥čüą║ąŠą╣ ą▓čÅąĘą║ąŠčüčéąĖ ąĖ
ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĮąŠą│ąŠ ąĮą░čéčÅąČąĄąĮąĖčÅ.
ąóąĄą╝ą┐ąĄčĆą░čéčāčĆąĮą░čÅ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéčī ą┤ą╗čÅ ą▓čÅąĘą║ąŠčüčéąĖ
ą╗ąĖąĮąĖą░ą╗ąĖąĘąŠą▓ą░ą╗ą░čüčī ą▓ ą║ąŠąŠčĆą┤ąĖąĮą░čéą░čģ ln (η/ηąŠ)
ŌĆō 1/T (ąĀąĖčü 2) ą▓ ą┤ą▓čāčģ ą┤ąĖą░ą┐ą░ąĘąŠąĮą░čģ 0 ŌĆō 20ąŠ
ąĖ 25 ŌĆō 45ąŠąĪ (ηąŠ ąĘąĮą░č湥ąĮąĖąĄ ą▓čÅąĘą║ąŠčüčéąĖ ą┐čĆąĖ 0ąŠąĪ).
ą×čåąĄąĮą║čā ą▓ąĄą╗ąĖčćąĖąĮ 菹ĮąĄčĆą│ąĖąĖ ą░ą║čéąĖą▓ą░čåąĖąĖ (ąĢą░) ą┤ą╗čÅ ą║ą░ąČą┤ąŠą│ąŠ
ą┤ąĖą░ą┐ą░ąĘąŠąĮą░ čüą┤ąĄą╗ą░ą╗ąĖ, ą┐ąŠą╗ą░ą│ą░čÅ, čćč鹊
η
~ ηąŠ exp
[ŌĆō(ąĢą░/RT)]. (4)
ą¤čĆąĖ čŹč鹊ą╝
tg α
= ąĢą░/R,
ą│ą┤ąĄ R = 8,31 ąöąČ/(ąÜ ą╝ąŠą╗čī) ŌĆō
čāąĮąĖą▓ąĄčĆčüą░ą╗čīąĮą░čÅ ą│ą░ąĘąŠą▓ą░čÅ ą┐ąŠčüč鹊čÅąĮąĮą░čÅ. ąśąĘą▓ąĄčüčéąĮąŠ [2], čćč鹊 菹ĮąĄčĆą│ąĖčÅ
ą░ą║čéąĖą▓ą░čåąĖąĖ ą▓čÅąĘą║ąŠą│ąŠ č鹥č湥ąĮąĖčÅ ą▒ą╗ąĖąĘą║ą░ ą║ 菹ĮąĄčĆą│ąĖąĖ ąØ-čüą▓čÅąĘąĖ (ąĢąĮ),
čĆą░ą▓ąĮąŠą╣ ą┤ą╗čÅ ą▓ąŠą┤čŗ 18,9 ą║ąöąČ ą╝ąŠą╗čīŌĆō1 [1]. ąĪ čŹč鹊ą╣ ą▓ąĄą╗ąĖčćąĖąĮąŠą╣
čģąŠčĆąŠčłąŠ čüąŠą│ą╗ą░čüčāąĄčéčüčÅ ąŠčåąĄąĮą║ą░ ąĢą░ ą┤ą╗čÅ ą┐ąĄčĆą▓ąŠą│ąŠ ą┤ąĖą░ą┐ą░ąĘąŠąĮą░
č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ. ąóąĄą╝ą┐ąĄčĆą░čéčāčĆčā t ~ 22ąŠąĪ,
ą▓ ą║ąŠč鹊čĆąŠą╣ ą╗ąĖąĮąĄą╣ąĮą░čÅ ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖčÅ ą┤ą╗čÅ ą▓čÅąĘą║ąŠčüčéąĖ ąĖčüą┐čŗčéčŗą▓ą░ąĄčé ąĖąĘą╗ąŠą╝,
ą╝ąŠąČąĮąŠ ąĮą░ąĘą▓ą░čéčī ą║čĆąĖčéąĖč湥čüą║ąŠą╣. ą×čéą╝ąĄčéąĖą╝, čćč鹊, ąĖ čģą░čĆą░ą║č鹥čĆ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ
ą▓čÅąĘą║ąŠčüčéąĖ ąŠčé ą┤ą░ą▓ą╗ąĄąĮąĖčÅ ą┐čĆąĄč鹥čĆą┐ąĄą▓ą░ąĄčé ąĖąĘą╝ąĄąĮąĄąĮąĖčÅ ą▓ čĆą░ą╣ąŠąĮąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆ
20-30ąŠąĪ [2].
ąóąŠčćą║ąĖ ą▓ąĄą╗ąĖčćąĖąĮ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĮąŠą│ąŠ ąĮą░čéčÅąČąĄąĮąĖčÅ
ą▓ ą┤ąĖą░ą┐ą░ąĘąŠąĮąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆ ąŠčé t ~ 13 ą┤ąŠ 80ąŠąĪ
ą╗ąŠąČąĖą╗ąĖčüčī ąĮą░ ą┐čĆčÅą╝čāčÄ ą╗ąĖąĮąĖčÄ ą▓ ą║ąŠąŠčĆą┤ąĖąĮą░čéą░čģ |ln
(σ/σąŠ)|1/2 ŌĆō 1/T
(ąĀąĖčü 3) (σąŠ ŌĆō ąĘąĮą░č湥ąĮąĖąĄ ą┐čĆąĖ 0,01ąŠąĪ).
ąÉą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖčÄ ą┐ąŠ ą░ąĮą░ą╗ąŠą│ąĖąĖ čü čāčĆą░ą▓ąĮąĄąĮąĖąĄą╝ (2) ą┐čĆąĄą┤čüčéą░ą▓ąĖą╗ąĖ ą▓ ą▓ąĖą┤ąĄ:
ln
(σ/σąŠ) = ŌĆōąÆ
(∆ąó/ąó)2, (5)
ą│ą┤ąĄ ∆ąó = ąó ŌĆö
ąóąŠ, ąÆ = (tgα
/ąóąŠ)2, ą░ ąóąŠ = 256ąÜ ŌĆō č鹊čćą║ą░
ą┐ąĄčĆąĄčüąĄč湥ąĮąĖčÅ ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ čü ąŠčüčīčÄ 1/ąó (ąĀąĖčü 2). ąśąĘ (5) ą╝ąŠąČąĮąŠ ą┐ąŠą╗čāčćąĖčéčī
ą░ąĮą░ą╗ąŠą│ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ ąÉčĆčĆąĄąĮąĖčāčüą░ (4):
σ = σąŠ
exp (ŌĆōąĢą░/ąó),
(6)
ąĄčüą╗ąĖ ą┐čĆąĖąĮčÅčéčī ąĘą░ ą▓ąĄą╗ąĖčćąĖąĮčā
ąĢą░ ą▓čŗčĆą░ąČąĄąĮąĖąĄ:
ąĢą░ = ąÆR
(∆ąó)2 ąóŌĆō1. (7)
ą¤ąŠ č乊čĆą╝čāą╗ąĄ (7) ąŠčåąĄąĮąĖą╗ąĖ
ą┐ąŠą│čĆą░ąĮąĖčćąĮčŗąĄ ąĘąĮą░č湥ąĮąĖčÅ ąĢą░ (ąóą░ą▒ą╗ąĖčåą░).
ą×ą▒čŗčćąĮąŠ 菹║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮčŗąĄ
č鹊čćą║ąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮčŗčģ ąĘą░ą▓ąĖčüąĖą╝ąŠčüč鹥ą╣ ą░ą┐ą┐čĆąŠą║čüąĖą╝ąĖčĆčāčÄčé ą┐ąŠą╗ąĖąĮąŠą╝ąĮčŗą╝ąĖ
čäčāąĮą║čåąĖčÅą╝ąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ, ą┐čāč鹥ą╝ ą┐ąŠą┤ą▒ąŠčĆą░ ą║ąŠčŹčäčäąĖčåąĖąĄąĮč鹊ą▓ ąĖ ą┐ąŠą║ą░ąĘą░č鹥ą╗ąĄą╣
čüč鹥ą┐ąĄąĮąĄą╣ [3]. ąÜ ą┐čĆąĖą╝ąĄčĆčā, ą┤ą╗čÅ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĮąŠą│ąŠ ąĮą░čéčÅąČąĄąĮąĖčÅ ą▓ąŠą┤čŗ ą▓
ą┤ąĖą░ą┐ą░ąĘąŠąĮąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆ ąŠčé 0,01 ą┤ąŠ 370ąŠąĪ ąĖčüą┐ąŠą╗čīąĘčāčÄčé čäčāąĮą║čåąĖčÄ
[5]:
σ = 235,5 (∆ąó/ąóčü)1,256[1
ŌĆō 0,625(∆ąó/ąóčü)]. (8)
ąōą┤ąĄ ąóčü =
647,096ąÜ. ąśą╗ąĖ ą┤ą╗čÅ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮąŠą╣ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ ą╝ąŠą╗čÅčĆąĮąŠą│ąŠ ąŠą▒čŖąĄą╝ą░ [2]:
∆V/Vą║čĆ
= 0,272 (∆T/Tą║čĆ)√3.
(9)
ąæąĄąĘčāą║ąŠčĆąĖąĘąĮąĄąĮąĮčŗąĄ čü č鹊čćą║ąĖ ąĘčĆąĄąĮąĖčÅ
ą╝ą░č鹥ą╝ą░čéąĖą║ąĖ ąĖ ą┐čĆą░ą║čéąĖą║ąĖ ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ čéąĖą┐ą░ (8) ąĖ (9), ą║ą░ą║ ą┐čĆą░ą▓ąĖą╗ąŠ, ąĮąĄ
čüąŠą┤ąĄčƹȹ░čé ą▓ čüąĄą▒ąĄ ą║ą░ą║ąŠą╣-ą╗ąĖą▒ąŠ čäąĖąĘąĖą║ąŠ-čģąĖą╝ąĖč湥čüą║ąŠą╣ ąĖąĮč乊čĆą╝ą░čåąĖąĖ. ą×čéą╝ąĄčéąĖą╝,
čćč鹊 菹║čüą┐ąĄčĆąĖą╝ąĄąĮčéą░ą╗čīąĮčŗąĄ č鹊čćą║ąĖ ∆V/Vą║čĆ,
ą▓ąĘčÅčéčŗąĄ ąĖąĘ [2], čéą░ą║ąČąĄ čāą┤ąŠą▓ą╗ąĄčéą▓ąŠčĆčÅčÄčé čāčĆą░ą▓ąĮąĄąĮąĖčÄ (2).
ą¤ą╗ąŠčéąĮąŠčüčéčī ąĖ ą╝ąŠą╗čÅčĆąĮčŗą╣ ąŠą▒čŖąĄą╝ ą▓ąŠą┤čŗ
čüą▓čÅąĘą░ąĮčŗ ąŠč湥ą▓ąĖą┤ąĮčŗą╝ čüąŠąŠčéąĮąŠčłąĄąĮąĖąĄą╝:
Vą║čĆ
ρą║čĆ = (Vą║čĆ
+ ∆V)
(ρą║čĆ + ∆ρ),
ąĖąĘ ą║ąŠč鹊čĆąŠą│ąŠ
čüą╗ąĄą┤čāąĄčé:
∆ρ/ρą║čĆ
= |∆V/Vą║čĆ|
ąĖą╗ąĖ ∆V/∆ρ
= Vą║čĆ
/ρą║čĆ.
ąĪ čāč湥č鹊ą╝ č鹊ą│ąŠ, čćč鹊
Vą║čĆ
= 18, 016 čüą╝3 ą╝ąŠą╗čīŌĆō1, ą░ ρą║čĆ
= 0,99997 ą│/čüą╝3, ąŠčéąĮąŠčłąĄąĮąĖąĄ ∆V/∆ρ
ą▒čāą┤ąĄčé čĆą░ą▓ąĮąŠ 18,02. ąĪ ą┤čĆčāą│ąŠą╣ čüč鹊čĆąŠąĮčŗ, ąĖąĘ ąĮą░čłąĖčģ čĆąĄąĘčāą╗čīčéą░č鹊ą▓ čüą╗ąĄą┤čāąĄčé,
∆V/∆ρ
= ąÆV/Bρ
= 11,0/0,61 = 18,03. ąźąŠčĆąŠčłąĄąĄ čüąŠą│ą╗ą░čüąĖąĄ ą▓ąĄą╗ąĖčćąĖąĮ čüą▓ąĖą┤ąĄč鹥ą╗čīčüčéą▓čāąĄčé ąŠ
ą┤ąŠčüčéą░č鹊čćąĮąŠą╣ č鹊čćąĮąŠčüčéąĖ ą┐ąŠą╗čāč湥ąĮąĮčŗčģ ąĮą░ą╝ąĖ ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖą╣.
ą×ą┤ąĖąĮą░ą║ąŠą▓čŗą╣ ą▓ąĖą┤ ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖą╣ (2) ą┤ą╗čÅ
ą┐ą╗ąŠčéąĮąŠčüčéąĖ, ą╝ąŠą╗čÅčĆąĮąŠą│ąŠ ąŠą▒čŖąĄą╝ą░, č鹥ą┐ą╗ąŠąĄą╝ą║ąŠčüčéąĖ, čüąČąĖą╝ą░ąĄą╝ąŠčüčéąĖ ąĖ čüą║ąŠčĆąŠčüčéąĖ
ąĘą▓čāą║ą░ čüą▓ąĖą┤ąĄč鹥ą╗čīčüčéą▓čāąĄčé ąŠ ąĮą░ą╗ąĖčćąĖąĖ čāąĮąĖą▓ąĄčĆčüą░ą╗čīąĮąŠą│ąŠ čäąĖąĘąĖč湥čüą║ąŠą│ąŠ
ą╝ąĄčģą░ąĮąĖąĘą╝ą░, ą╗ąĄąČą░čēąĄą│ąŠ ą▓ ąŠčüąĮąŠą▓ąĄ ą░ąĮąŠą╝ą░ą╗ąĖą╣ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖčģ čüą▓ąŠą╣čüčéą▓
ą▓ąŠą┤čŗ. ąōą╗ą░ą▓ąĮąŠą╣ ąŠčüąŠą▒ąĄąĮąĮąŠčüčéčīčÄ ą┤ą░ąĮąĮąŠą│ąŠ ą╝ąĄčģą░ąĮąĖąĘą╝ą░ čÅą▓ą╗čÅąĄčéčüčÅ ą▒ąĄąĘą▒ą░čĆčīąĄčĆąĮčŗą╣
čģą░čĆą░ą║č鹥čĆ ąĄą│ąŠ ą║ąĖąĮąĄčéąĖą║ąĖ, čćč鹊 ą╝ąŠąČąĄčé ą▒čŗčéčī čüą╗ąĄą┤čüčéą▓ąĖąĄą╝ čüąĖąĮąĄčĆą│ąĖąĘą╝ą░ ą┤ą▓čāčģ
ą┐čĆąŠčåąĄčüčüąŠą▓ ą▓ ą╝ąĄčģą░ąĮąĖąĘą╝ąĄ ą┐ąĄčĆąĄčüčéčĆąŠą╣ą║ąĖ ąĮą░ą┤ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ čüčéčĆčāą║čéčāčĆčŗ ą▓ąŠą┤čŗ. ąĢąĄ
菹╗ąĄą╝ąĄąĮčéą░čĆąĮčŗą╝ąĖ čÅč湥ą╣ą║ą░ą╝ąĖ čÅą▓ą╗čÅčÄčéčüčÅ ą┤ąĖąĮą░ą╝ąĖčćąĮčŗąĄ ą║ą╗ą░čüč鹥čĆčŗ-č鹥čéčĆą░菹┤čĆčŗ,
ąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĮčŗąĄ ąĖąĘ č湥čéčŗčĆąĄčģ ą╝ąŠą╗ąĄą║čāą╗ ą▓ąŠą┤čŗ, čüą▓čÅąĘą░ąĮąĮčŗčģ ą╝ąĄąČą┤čā čüąŠą▒ąŠą╣
ąØ-čüą▓čÅąĘčÅą╝ąĖ (4-č鹥čéčĆą░菹┤čĆ) ąĖą╗ąĖ ąĖąĘ ą┐čÅčéąĖ ą╝ąŠą╗ąĄą║čāą╗ ąØ2ą× (ąŠą▒čŖąĄą╝ąĮąŠ
čåąĄąĮčéčĆąĖčĆąŠą▓ą░ąĮąĮčŗą╣ 5-č鹥čéčĆą░菹┤čĆ). ąśąĘ čŹčéąĖčģ č鹥čéčĆą░菹┤čĆąŠą▓ ąŠą▒čĆą░ąĘčāčÄčéčüčÅ ą▒ąŠą╗ąĄąĄ
čüą╗ąŠąČąĮčŗąĄ čüčéčĆčāą║čéčāčĆčŗ ą║ą╗ą░čüč鹥čĆąŠą▓ čü čĆą░ąĘą╗ąĖčćąĮąŠą╣ ą┐ą╗ąŠčéąĮąŠčüčéčīčÄ ąĮą░ą┐ąŠą╗ąĮąĄąĮąĖčÅ ąĖčģ
ąŠą▒čŖąĄą╝ąŠą▓ ą╝ąŠą╗ąĄą║čāą╗ą░ą╝ąĖ ą▓ąŠą┤čŗ. ąĀą░ą▓ąĮąŠą▓ąĄčüąĖąĄ ąĖ ą┐ąĄčĆąĄčģąŠą┤čŗ
ą╝ąĄąČą┤čā 4- ąĖ 5-č鹥čéčĆą░菹┤čĆą░ą╝ąĖ, ą░ čéą░ą║ąČąĄ ąĖ ą╝ąĄąČą┤čā ą▒ąŠą╗ąĄąĄ čüą╗ąŠąČąĮčŗą╝ąĖ ą║ą╗ą░čüč鹥čĆą░ą╝ąĖ
čü čāčćą░čüčéąĖąĄą╝ čüą▓ąŠą▒ąŠą┤ąĮčŗčģ ą╝ąŠą╗ąĄą║čāą╗ ą▓ąŠą┤čŗ ą▓ą║ą╗čÄčćą░čÄčé čģąĖą╝ąĖč湥čüą║čāčÄ čüčéą░ą┤ąĖčÄ (čĆą░ąĘčĆčŗą▓
ą▓ąŠą┤ąŠčĆąŠą┤ąĮąŠą╣ čüą▓čÅąĘąĖ) ąĖ ą┤ąĖčäčäčāąĘąĮčāčÄ (ą╝ąĖą│čĆą░čåąĖčÅ ą╝ąŠą╗ąĄą║čāą╗čŗ ą▓ąŠą┤čŗ ą▓ ą┐ąŠą╗ąŠčüčéčī ąĖą╗ąĖ
ąĖąĘ ą┐ąŠą╗ąŠčüčéąĖ ą║ą╗ą░čüč鹥čĆą░). ąÉą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ (2) ą╝ąŠąČąĮąŠ ą┐ąŠą╗čāčćąĖčéčī, ąĖčüą┐ąŠą╗čīąĘčāčÅ
ą┐ąŠą╗ąŠąČąĄąĮąĖčÅ čģąĖą╝ąĖč湥čüą║ąŠą╣ ą║ąĖąĮąĄčéąĖą║ąĖ ą│ąĄč鹥čĆąŠą│ąĄąĮąĮčŗčģ ą┐čĆąŠčåąĄčüčüąŠą▓ ąĖ č鹊čé čäą░ą║čé, čćč鹊
ąĢą░ ≈ ąĢąĮ. ąĪą║ąŠčĆąŠčüčéčī čĆąĄą░ą║čåąĖąĖ ą┐ąĄčĆąĄčüčéčĆąŠą╣ą║ąĖ
ą║ą╗ą░čüč鹥čĆąĮąŠą╣ čüčéčĆčāą║čéčāčĆčŗ ą▓ąŠą┤čŗ ą▒čāą┤ąĄčé ą┐čĆąŠą┐ąŠčĆčåąĖąŠąĮą░ą╗čīąĮą░ ą┐čĆąŠąĖąĘą▓ąĄą┤ąĄąĮąĖčÄ
ą║ąŠąĮčüčéą░ąĮčéčŗ čüą║ąŠčĆąŠčüčéąĖ čģąĖą╝ąĖč湥čüą║ąŠą╣ čĆąĄą░ą║čåąĖąĖ ąĖ ą║ąŠčŹčäčäąĖčåąĖąĄąĮčéą░ ą┤ąĖčäčäčāąĘąĖąĖ (D):
W
~ KčģąĖą╝ D.
(10)
ą¤ąŠą┤čüčéą░ą▓ąĖą▓ ą▓ (10) ąĖąĘą▓ąĄčüčéąĮčŗąĄ ą▓čŗčĆą░ąČąĄąĮąĖčÅ
ą┤ą╗čÅ D ~ T/η ~T/exp
(ŌĆōEą░/RT)
ąĖ ąÜčģąĖą╝ ~ T exp (ŌĆōEąĮ/RT),
ą┐ąŠą╗čāčćąĖą╝:
W
~ ąó2. (11)
ąÆą▒ą╗ąĖąĘąĖ ą║čĆąĖčéąĖč湥čüą║ąŠą╣ č鹊čćą║ąĖ ąŠčüąĮąŠą▓ąĮčāčÄ čĆąŠą╗čī
ą▓ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖčģ ą┐čĆąŠčåąĄčüčüą░čģ ą▒čāą┤čāčé ąĖą│čĆą░čéčī č鹥ą┐ą╗ąŠą▓čŗąĄ ą║ą▓ą░ąĮčéčŗ
k (∆T)
(k
= 1,38 10ŌĆō23 ąöąČ ąÜŌĆō1). ąÆ ą┐čĆąĄą┤ąĄą╗ą░čģ čüąŠąŠčéąĮąŠčłąĄąĮąĖčÅ ∆T
┬½ ąó, ą┐čĆąĄąĮąĄą▒čĆąĄą│ą░čÅ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéčīčÄ ∆ąÉ ą▓ (2) ąŠčé ąó ąĖ ą┐ąŠą╗ą░ą│ą░čÅ ∆ąÉ ~
W,
ąĖąĘ (11) ą┐ąŠą╗čāčćąĖą╝:
∆ąÉ
~ (∆ąó)2.
(12)
ą¤ąŠčÅą▓ą╗ąĄąĮąĖąĄ 菹ĮąĄčĆą│ąĖąĖ ą░ą║čéąĖą▓ą░čåąĖąĖ (ąĢσ)
ą▓ ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮąŠą╣ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ ą┐ąŠą▓ąĄčĆčģąĮąŠčüčéąĮąŠą│ąŠ ąĮą░čéčÅąČąĄąĮąĖčÅ
ą▓ąŠą┤čŗ, ą┐ąŠ-ą▓ąĖą┤ąĖą╝ąŠą╝čā, ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮąŠ čüą┐ąĄčåąĖčäąĖą║ąŠą╣ ą│ąĄč鹥čĆąŠą│ąĄąĮąĮčŗčģ čĆąĄą░ą║čåąĖą╣
ą║ą╗ą░čüč鹥čĆąŠą▓ ąĮą░ ą│čĆą░ąĮąĖčåąĄ čĆą░ąĘą┤ąĄą╗ą░ ąČąĖą┤ą║ąŠčüčéčī-ą┐ą░čĆ, ąĖąĘ-ąĘą░ ą║ąŠč鹊čĆąŠą╣, ą║ ą┐čĆąĖą╝ąĄčĆčā,
ą╝ąŠą│ ąĮą░čĆčāčłąĖčéčīčüčÅ ą▒ą░ą╗ą░ąĮčü ą╝ąĄąČą┤čā ąĢą░ ąĖ ąĢąĮ, ąĖ ą▓ą╝ąĄčüč鹊
(2) ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖčÅ ą┤ą╗čÅ σ ą┐čĆąĖąŠą▒čĆąĄą╗ą░ ą▓ąĖą┤ (6).
ąØą░ ąĀąĖčü 3 ą┐čĆąĄą┤čüčéą░ą▓ą╗ąĄąĮčŗ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéąĖ čāą│ą╗ą░
ą▓čĆą░čēąĄąĮąĖčÅ ą┐ą╗ąŠčüą║ąŠčüčéąĖ ą┐ąŠą╗čÅčĆąĖąĘą░čåąĖąĖ čüą▓ąĄčéą░ (α) ąŠčé ą▓čĆąĄą╝ąĄąĮąĖ ą┤ą╗čÅ čäąĖąĘčĆą░čüčéą▓ąŠčĆąŠą▓
ąČąĄą╗ą░čéąĖąĮčŗ (4 %) (čĆą░čüčéą▓ąŠčĆ-I) ąĖ ąČąĄą╗ą░čéąĖąĮčŗ
(2 %) + čüą░čģą░čĆ (10 %) (čĆą░čüčéą▓ąŠčĆ-II).
ąĀą░čüčéą▓ąŠčĆ-I ąĖąĘąĮą░čćą░ą╗čīąĮąŠ ąĖą╝ąĄą╗ čüčéčāą┤ąĮąĄąŠą▒čĆą░ąĘąĮąŠąĄ
čüąŠčüč鹊čÅąĮąĖąĄ (ą┐čāąĘčŗčĆąĄą║ ą▓ąŠąĘą┤čāčģą░ ą▓ ą║čÄą▓ąĄč鹥 ąĮąĄ ą┤ą▓ąĖą│ą░ą╗čüčÅ), ą▓ č鹊 ą▓čĆąĄą╝čÅ ą║ą░ą║
ą┐čāąĘčŗčĆąĄą║ ą▓ąŠąĘą┤čāčģą░ ą▓ čĆą░čüčéą▓ąŠčĆąĄ-II čüąŠčģčĆą░ąĮčÅą╗
ą┐ąŠą┤ą▓ąĖąČąĮąŠčüčéčī. ą×ą▒čĆą░čéąĖą╝ąŠąĄ čāą▓ąĄą╗ąĖč湥ąĮąĖąĄ |α| ąĮą░ ą║čĆąĖą▓ąŠą╣ 2 ąĖ čüąĮąĖąČąĄąĮąĖąĄ α ąĮą░
ą║čĆąĖą▓ąŠą╣ 3 ą▓ č鹊čćą║ą░čģ 13.00 ąĖ 14.00 čćą░čüąŠą▓ 05.02.05, ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮąŠ
ą║čĆą░čéą║ąŠą▓čĆąĄą╝ąĄąĮąĮčŗą╝ ąŠčģą╗ą░ąČą┤ąĄąĮąĖąĄą╝ čĆą░čüčéą▓ąŠčĆąŠą▓ ą┤ąŠ č鹥ą╝ą┐ąĄčĆą░čéčāčĆ 18ąŠąĪ
ąĖ 5ąŠąĪ, čüąŠąŠčéą▓ąĄčéčüčéą▓ąĄąĮąĮąŠ. ąĀą░čüčéą▓ąŠčĆ-II
ą┐čĆąĖ 5ąŠąĪ č鹊ąČąĄ čüčéą░ą╗ čüčéčāą┤ąĮąĄąŠą▒čĆą░ąĘąĮčŗą╝. ąśąĘ ąĮą░ą║ą╗ąŠąĮąŠą▓ ą║čĆąĖą▓čŗčģ
ąŠčåąĄąĮąĖą╗ąĖ čüą║ąŠčĆąŠčüčéąĖ čāą▓ąĄą╗ąĖč湥ąĮąĖčÅ α čĆą░čüčéą▓ąŠčĆą░-I ąĖ
čüąĮąĖąČąĄąĮąĖčÅ α čĆą░čüčéą▓ąŠčĆą░-II (210ŌĆō5 ąĖ
ŌĆō4 10ŌĆō5 ą│čĆą░ą┤/čü, čüąŠąŠčéą▓ąĄčéčüčéą▓ąĄąĮąĮąŠ).
ą×ą┐čéąĖč湥čüą║ą░čÅ ą░ą║čéąĖą▓ąĮąŠčüčéčī čĆą░čüčéą▓ąŠčĆąŠą▓
ąČąĄą╗ą░čéąĖąĮčŗ ąŠą▒čāčüą╗ąŠą▓ą╗ąĄąĮą░ ą░ą╝ąĖąĮąŠą║ąĖčüą╗ąŠčéąĮčŗą╝ąĖ ąŠčüčéą░čéą║ą░ą╝ąĖ ą▒ąĄą╗ą║ą░. ąśčģ
čüą░ą╝ąŠąŠčĆą│ą░ąĮąĖąĘą░čåąĖčÅ ą▓ ą║ąŠą╗ą╗ą░ą│ąĄąĮąŠą┐ąŠą┤ąŠą▒ąĮčŗąĄ čüą┐ąĖčĆą░ą╗ąĖ, ąĖą╝ąĄčÄčēąĖąĄ ąŠčéčĆąĖčåą░č鹥ą╗čīąĮčāčÄ
čģąĖčĆą░ą╗čīąĮąŠčüčéčī [6] ą▓ąĄą┤ąĄčé ą║ čāą▓ąĄą╗ąĖč湥ąĮąĖčÄ α ąČąĄą╗ą░čéąĖąĮąŠą▓čŗčģ čĆą░čüčéą▓ąŠčĆąŠą▓ čüąŠ
ą▓čĆąĄą╝ąĄąĮąĄą╝. ąæąŠą╗ąĄąĄ ą▒čŗčüčéčĆąŠąĄ čüąĮąĖąČąĄąĮąĖąĄ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮąŠą╣ čģąĖčĆą░ą╗čīąĮąŠčüčéąĖ čüą░čģą░čĆą░ ą┐ąŠ
čüčĆą░ą▓ąĮąĄąĮąĖčÄ čü ąĮą░čĆą░čüčéą░ąĮąĖąĄą╝ ąŠčéčĆąĖčåą░č鹥ą╗čīąĮąŠą╣ čģąĖčĆą░ą╗čīąĮąŠčüčéąĖ ą║ąŠą╗ą╗ą░ą│ąĄąĮą░ ą╝ąŠąČąĄčé
ą▒čŗčéčī čüą▓čÅąĘą░ąĮąŠ čü č鹥ą╝, čćč鹊 ąĮą░ ąŠą┐čéąĖč湥čüą║ąŠą╣ ą░ą║čéąĖą▓ąĮąŠčüčéąĖ čüą░čģą░čĆą░ ąŠčéčĆąĖčåą░č鹥ą╗čīąĮąŠ
čüą║ą░ąĘčŗą▓ą░ąĄčéčüčÅ ąĖ ąĖąĘą╝ąĄąĮąĄąĮąĖąĄ ąĮą░ą┤ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ čüčéčĆčāą║čéčāčĆčŗ čĆą░čüčéą▓ąŠčĆą░
ą▓čüą╗ąĄą┤čüčéą▓ąĖąĄ čāą▓ąĄą╗ąĖč湥ąĮąĖčÅ ą┐ą╗ąŠčéąĮąŠčüčéąĖ ą┐ąŠą┐ąĄčĆąĄčćąĮčŗčģ ąØ-čüą▓čÅąĘąĄą╣ ą╝ąĄąČą┤čā
ą║ąŠą╗ą╗ą░ą│ąĄąĮąŠą▓čŗą╝ąĖ čüą┐ąĖčĆą░ą╗čÅą╝ąĖ. ą¤čĆąĖ ą┐ąĄčĆąĄčģąŠą┤ąĄ ą│ąĄą╗čÅ ą▓ čüčéčāą┤ąĄąĮčī, ą║ ą┐čĆąĖą╝ąĄčĆčā,
ą╝ąŠąČąĄčé čüąĮąĖąĘąĖčéčīčüčÅ ąŠčĆąĖąĄąĮčéą░čåąĖąŠąĮąĮą░čÅ ą┐ąŠą╗čÅčĆąĖąĘčāąĄą╝ąŠčüčéčī ą╝ąŠą╗ąĄą║čāą╗ čüą░čģą░čĆą░. ąØą░
ąŠčüąĮąŠą▓ą░ąĮąĖąĖ ą┤ą░ąĮąĮčŗčģ čĆąĄąĘčāą╗čīčéą░č鹊ą▓ ą╝ąŠąČąĮąŠ čüą║ą░ąĘą░čéčī, čćč鹊 čäąĖąĘąĖč湥čüą║ąĖąĄ čüą▓ąŠą╣čüčéą▓ą░
čģąĖčĆą░ą╗čīąĮčŗčģ ą╝ąĄčéą░ą▒ąŠą╗ąĖč鹊ą▓, ą┐čĆąĖčüčāčéčüčéą▓čāčÄčēąĖčģ ą▓ ą▓ąŠą┤ąĄ, ąĘą░ą▓ąĖčüčÅčé ąŠčé ąĘąĮą░ą║ą░ ąĖ
čāčĆąŠą▓ąĮčÅ ąĖ ąĘąĮą░ą║ą░ ąŠą┐čéąĖč湥čüą║ąŠą╣ ą░ą║čéąĖą▓ąĮąŠčüčéąĖ ąĮą░ą┤ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮčŗčģ čüčéčĆčāą║čéčāčĆ čüą░ą╝ąŠą╣
ą▓ąŠą┤čŗ.
ąĀąĖčü 3.
ąŚą░ą▓ąĖčüąĖą╝ąŠčüčéčī ąŠą┐čéąĖč湥čüą║ąŠą╣ ą░ą║čéąĖą▓ąĮąŠčüčéąĖ čĆą░čüčéą▓ąŠčĆąŠą▓ ąŠčé ą▓čĆąĄą╝ąĄąĮąĖ (č乥ą▓čĆą░ą╗čī
2005 ą│ąŠą┤ą░) ąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ. 1 ŌĆō čäąĖąĘčĆą░čüčéą▓ąŠčĆ + ąČąĄą╗ą░čéąĖąĮ (4 %), ą║čÄą▓ąĄčéą░
100 ą╝ą╝;
2 ŌĆō čäąĖąĘčĆą░čüčéą▓ąŠčĆ + ąČąĄą╗ą░čéąĖąĮ (2 %) + čüą░čģą░čĆ
(10 %) (ą║čÄą▓ąĄčéą░ 200 ą╝ą╝).
ą¤čāąĮą║čéąĖčĆąĮčŗą╝ąĖ ą╗ąĖąĮąĖčÅą╝ąĖ ąŠą▒ąŠąĘąĮą░č湥ąĮčŗ ąĮą░ą║ą╗ąŠąĮčŗ
ą║čĆąĖą▓čŗčģ.
ąæąĄąĘą▒ą░čĆčīąĄčĆąĮąŠčüčéčī ą┐ąĄčĆąĄčüčéčĆąŠąĄą║
ąĮą░ą┤ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ čüčéčĆčāą║čéčāčĆčŗ ąČąĖą┤ą║ąŠą╣ ą▓ąŠą┤čŗ ą▓ čłąĖčĆąŠą║ąŠą╝ ą┤ąĖą░ą┐ą░ąĘąŠąĮąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆ
ąĖ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéčī ąŠčé ąĮąĄąĄ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖčģ čüą▓ąŠą╣čüčéą▓ čĆą░čüčéą▓ąŠčĆąĄąĮąĮčŗčģ ą▓ąĄčēąĄčüčéą▓
ą╝ąŠąČąĮąŠ ą┐čĆąĖą▓ą╗ąĄčćčī ą┤ą╗čÅ ą▓čŗčÅčüąĮąĄąĮąĖčÅ čäąĖąĘąĖą║ąĖ čüčéčĆą░čéąĖčäąĖą║ą░čåąĖąĖ ąĖ čÅčĆąŠą▓ąĖąĘą░čåąĖąĖ.
ąØą░ąĖą▒ąŠą╗ąĄąĄ ą▓čŗčĆą░ąČąĄąĮą░ čüą┐ąĄčåąĖčäąĖą║ą░ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖčģ čüą▓ąŠą╣čüčéą▓ ą▓ąŠą┤čŗ ą▓ čÅą▓ą╗ąĄąĮąĖąĖ
čüčéčĆą░čéąĖčäąĖą║ą░čåąĖąĖ, čŹčäč乥ą║čéąĖą▓ąĮąŠčüčéčī ą║ąŠč鹊čĆąŠą╣ čüą╗ąĄą┤čāąĄčé čüą▓čÅąĘą░čéčī, ą┐čĆąĄąČą┤ąĄ ą▓čüąĄą│ąŠ,
čü ą░ąĮąŠą╝ą░ą╗čīąĮčŗą╝ąĖ čüą▓ąŠą╣čüčéą▓ą░ą╝ąĖ ąĮą░ą┤ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ čüčéčĆčāą║čéčāčĆčŗ ą▓ąŠą┤čŗ ą┐čĆąĖ ąóą║čĆ
= 4ąŠąĪ. ąöąŠą╝ąĖąĮąĖčĆąŠą▓ą░ąĮąĖąĄ ą▓ ąĮąĄą╣ č鹥čéčĆą░菹┤čĆą░ą╗čīąĮčŗčģ ą║ą╗ą░čüč鹥čĆąŠą▓
ą┐ąŠąĘą▓ąŠą╗ąĖą╗ąŠ čüčĆą░ą▓ąĮąĖčéčī ąĄąĄ čü ą║čĆąĖčüčéą░ą╗ą╗ąĖč湥čüą║ąŠą╣ čüčéčĆčāą║čéčāčĆąŠą╣ ą║ą▓ą░čĆčåą░ [7]. ąĢčüą╗ąĖ
ą┐čĆąŠą┤ąŠą╗ąČąĖčéčī čŹč鹊 čüčĆą░ą▓ąĮąĄąĮąĖąĄ, č鹊 ą┤ą╗čÅ ąĮą░ą┤ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ čüčéčĆčāą║čéčāčĆčŗ ą▓ąŠą┤čŗ
čüą╗ąĄą┤čāąĄčé ą┐ąŠčüčéčāą╗ąĖčĆąŠą▓ą░čéčī ąĮą░ą╗ąĖčćąĖąĄ ą┤ąĖąĮą░ą╝ąĖč湥čüą║ąŠą╣ čģąĖčĆą░ą╗čīąĮąŠčüčéąĖ,
čüąŠąŠčéą▓ąĄčéčüčéą▓čāčÄčēąĄą╣ ąŠą┐čéąĖč湥čüą║ąŠą╣ ą░ą║čéąĖą▓ąĮąŠčüčéąĖ ą║ą╗ą░čüč鹥čĆąĮčŗčģ čüčéčĆčāą║čéčāčĆ,
ąĖąĘąŠą╝ąŠčĆčäąĮčŗčģ ą┐ąŠą╗ąĖą╝ąĄčĆąĮčŗą╝ čåąĄą┐ąŠčćą║ą░ą╝ ąĖąĘ č鹥čéčĆą░菹┤čĆąŠą▓ ą▓ čüčéčĆčāą║čéčāčĆąĄ ą║ą▓ą░čĆčåą░.
ąĪčéą░čåąĖąŠąĮą░čĆąĮą░čÅ ą║ąŠąĮčåąĄąĮčéčĆą░čåąĖčÅ čģąĖčĆą░ą╗čīąĮčŗčģ ą║ą╗ą░čüč鹥čĆąŠą▓ ą▒čāą┤ąĄčé ąĘą░ą▓ąĖčüąĄčéčī ąŠčé ąĖčģ
ą▓čĆąĄą╝ąĄąĮąĖ ąČąĖąĘąĮąĖ ąĖ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ ą▓ąŠą┤čŗ. ąĪąĖąĮąĄčĆą│ąĖąĘą╝ ą┤ąĖąĮą░ą╝ąĖč湥čüą║ąŠą╣ ąŠą┐čéąĖč湥čüą║ąŠą╣
ą░ą║čéąĖą▓ąĮąŠčüčéąĖ ą▓ąŠą┤čŗ ąĖ ą▓ąĮąĄčłąĮąĄą│ąŠ čäą░ą║č鹊čĆą░ ą░čüąĖą╝ą╝ąĄčéčĆąĖąĖ 菹╗ąĄą║čéčĆąŠą╝ą░ą│ąĮąĖčéąĮąŠą╣ ąĖą╗ąĖ
ąĖąĮąŠą╣ ą┐čĆąĖčĆąŠą┤čŗ [8, 9], ą╝ąŠąČąĄčé ą╗ąĄąČą░čéčī ą▓ ąŠčüąĮąŠą▓ąĄ čäąĖąĘąĖą║ąĖ ąĮąŠą╝ąŠą│ąĄąĮąĄąĘą░. ąóą░ą║ąĖą╝
ąŠą▒čĆą░ąĘąŠą╝, ąĮąĖąĘą║ąĖąĄ ą┐ąŠą╗ąŠąČąĖč鹥ą╗čīąĮčŗąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ, ą░ą║čéąĖą▓ąĖąĘąĖčĆčāčÅ ą┤ąĄą╣čüčéą▓ąĖąĄ
ą▓ąĮąĄčłąĮąĄą│ąŠ čäą░ą║č鹊čĆą░ ą░čüąĖą╝ą╝ąĄčéčĆąĖąĖ, ą╝ąŠą│čāčé ąĖąĮąĖčåąĖąĖčĆąŠą▓ą░čéčī ąĮą░ ąĮą░čćą░ą╗čīąĮčŗčģ čüčéą░ą┤ąĖčÅčģ
ąŠąĮč鹊ą│ąĄąĮąĄąĘą░ čĆą░čüč鹥ąĮąĖą╣ č乥čĆą╝ąĄąĮčéą░čéąĖą▓ąĮčŗą╣ čüąĖąĮč鹥ąĘ čģąĖčĆą░ą╗čīąĮčŗčģ ą│ąŠčĆą╝ąŠąĮąŠą▓ čĆąŠčüčéą░ ąĖ
čåą▓ąĄč鹥ąĮąĖčÅ [1]. ąÆ čŹč鹊ą╝, ąŠč湥ą▓ąĖą┤ąĮąŠ, ąĖ ąĘą░ą║ą╗čÄčćą░ąĄčéčüčÅ ą│ą╗ą░ą▓ąĮčŗą╣ čĆąĄąĘčāą╗čīčéą░čé
čüčéčĆą░čéąĖčäąĖą║ą░čåąĖąĖ ąĖ čÅčĆąŠą▓ąĖąĘą░čåąĖąĖ.
ą¤čĆąĄą┤ą┐ąŠą╗ąŠąČąĄąĮąĖąĄ ąŠ čüą▓čÅąĘąĖ ąŠčüąŠą▒ąĄąĮąĮąŠčüč鹥ą╣
č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖčģ čüą▓ąŠą╣čüčéą▓ ą▓ąŠą┤čŗ čü ąŠą┐čéąĖč湥čüą║ąŠą╣ ą░ą║čéąĖą▓ąĮąŠčüčéčīčÄ ąĄąĄ
ą┤ąĖąĮą░ą╝ąĖčćąĮčŗčģ ą║ą╗ą░čüč鹥čĆąŠą▓ čüąŠą│ą╗ą░čüčāąĄčéčüčÅ čü ą╝ąĄčģą░ąĮąĖąĘą╝ąŠą╝ čĆąĄąĘąŠąĮą░ąĮčüąĮąŠą│ąŠ
ą┐ąŠą│ą╗ąŠčēąĄąĮąĖčÅ ą║ą╗ą░čüč鹥čĆą░ą╝ąĖ ą▓ąŠą┤čŗ ąĖąĘą╗čāč湥ąĮąĖčÅ ą╝ąĖą╗ą╗ąĖą╝ąĄčéčĆąŠą▓ąŠą│ąŠ ą┤ąĖą░ą┐ą░ąĘąŠąĮą░ [10].
ą× čĆąĄąĘąŠąĮą░ąĮčüąĄ čüą▓ąĖą┤ąĄč鹥ą╗čīčüčéą▓čāąĄčé ą▒ą╗ąĖąĘąŠčüčéčī ą┐ąŠčĆčÅą┤ą║ąŠą▓ ą▓čĆąĄą╝ąĄąĮąĖ ąČąĖąĘąĮąĖ
ą║ą╗ą░čüč鹥čĆąŠą▓ ąĖ ąŠą▒čĆą░čéąĮąŠą╣ čćą░čüč鹊čéčŗ ąĖąĘą╗čāč湥ąĮąĖčÅ 10 ŌĆō 100 ąōąōčå. ąŁąĮąĄčĆą│ąĖčÅ ą║ą▓ą░ąĮčéą░
ą╝ąĖą╗ą╗ąĖą╝ąĄčéčĆąŠą▓ąŠą│ąŠ ą┤ąĖą░ą┐ą░ąĘąŠąĮą░ ą┐ąŠ ą┐ąŠčĆčÅą┤ą║čā ą▓ąĄą╗ąĖčćąĖąĮčŗ ą▒ą╗ąĖąĘą║ą░ ą║ ą║ą▓ą░ąĮčéčā
č鹥ą┐ą╗ąŠą▓ąŠą╣ 菹ĮąĄčĆą│ąĖąĖ k∆ąó,
ą║ąŠč鹊čĆą░čÅ, ą║ą░ą║ čüą╗ąĄą┤čāąĄčé ąĖąĘ (12), ąĖą│čĆą░ąĄčé ąŠčüąĮąŠą▓ąĮčāčÄ čĆąŠą╗čī ą▓ ą┐ąĄčĆąĄčüčéčĆąŠą╣ą║ą░čģ
ąĮą░ą┤ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ čüčéčĆčāą║čéčāčĆčŗ ą▓ąŠą┤čŗ. ą×čéą╝ąĄčéąĖą╝ čéą░ą║ąČąĄ, čćč鹊 ą┐čĆąĖ ąĖčüą║čāčüčüčéą▓ąĄąĮąĮąŠą╣
čüčéčĆą░čéąĖčäąĖą║ą░čåąĖąĖ ą▓ čüąŠčüčéą░ą▓ąĄ čüčāą▒čüčéčĆą░čéą░, ą║ą░ą║ ą┐čĆą░ą▓ąĖą╗ąŠ, ąĖčüą┐ąŠą╗čīąĘčāčÄčé ą┐ąĄčüąŠą║,
čüąŠą┤ąĄčƹȹ░čēąĖą╣ ą║ą▓ą░čĆčåąĄą▓čŗąĄ čćą░čüčéąĖčåčŗ. ą¦ą░čüč鹊čéąĮą░čÅ ą╝ąŠą┤čāą╗čÅčåąĖčÅ ąĖ ą┐ąŠą╗čÅčĆąĖąĘą░čåąĖčÅ
ą║ą▓ą░čĆčåąĄą▓čŗą╝ąĖ čćą░čüčéąĖčåą░ą╝ąĖ ąĄčüč鹥čüčéą▓ąĄąĮąĮąŠą│ąŠ 菹╗ąĄą║čéčĆąŠą╝ą░ą│ąĮąĖčéąĮąŠą│ąŠ č乊ąĮą░, ąŠč湥ą▓ąĖą┤ąĮąŠ,
čüą┐ąŠčüąŠą▒čüčéą▓čāąĄčé čĆąĄąĘąŠąĮą░ąĮčüąĮąŠą╝čā ą┐ąŠą│ą╗ąŠčēąĄąĮąĖčÄ ąŠą┐čéąĖč湥čüą║ąĖ ą░ą║čéąĖą▓ąĮčŗą╝ąĖ ą║ą╗ą░čüč鹥čĆą░ą╝ąĖ
ą▓ąŠą┤čŗ ą▓ čĆą░čüčéąĖč鹥ą╗čīąĮčŗčģ ą║ą╗ąĄčéą║ą░čģ ą▒ąĖąŠą│ąĄąĮąĮčŗčģ ą║ą▓ą░ąĮč鹊ą▓ 菹ĮąĄčĆą│ąĖąĖ.
ąŚą░ą║ą╗čÄč湥ąĮąĖąĄ
ą¤ąŠą╗čāč湥ąĮąĮčŗąĄ ą▓ čĆą░ą▒ąŠč鹥 ąŠą┤ąĖąĮą░ą║ąŠą▓čŗąĄ ą┐ąŠ
č乊čĆą╝ąĄ ą╗ąĖąĮąĄą╣ąĮčŗąĄ ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ ą░ąĮąŠą╝ą░ą╗čīąĮčŗčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮčŗčģ ąĘą░ą▓ąĖčüąĖą╝ąŠčüč鹥ą╣
ą┐ą╗ąŠčéąĮąŠčüčéąĖ, č鹥ą┐ą╗ąŠąĄą╝ą║ąŠčüčéąĖ, čüą║ąŠčĆąŠčüčéąĖ ąĘą▓čāą║ą░ ąĖ čüąČąĖą╝ą░ąĄą╝ąŠčüčéąĖ ą▓ ą┤ąĖą░ą┐ą░ąĘąŠąĮąĄ
č鹥ą╝ą┐ąĄčĆą░čéčāčĆ ąŠčé 0 ą┤ąŠ 80ąŠąĪ čüą▓ąĖą┤ąĄč鹥ą╗čīčüčéą▓čāčÄčé ąŠą▒
čāąĮąĖą▓ąĄčĆčüą░ą╗čīąĮąŠčüčéąĖ ą╝ąĄčģą░ąĮąĖąĘą╝ą░ ą┐ąĄčĆąĄčüčéčĆąŠą╣ą║ąĖ ąĮą░ą┤ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ čüčéčĆčāą║čéčāčĆčŗ
ą▓ąŠą┤čŗ, ąŠčéą▓ąĄčćą░čÄčēąĄą│ąŠ ąĘą░ ą░ąĮąŠą╝ą░ą╗ąĖąĖ ąĄąĄ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖčģ čüą▓ąŠą╣čüčéą▓.
ą×čéčüčāčéčüčéą▓ąĖąĄ ą░ą║čéąĖą▓ą░čåąĖąŠąĮąĮąŠą│ąŠ ą▒ą░čĆčīąĄčĆą░ ą▓ ą┐ąĄčĆąĄčüčéčĆąŠą╣ą║ą░čģ ą┤ąĖąĮą░ą╝ąĖčćąĮčŗčģ
ą║ą╗ą░čüč鹥čĆąĮčŗčģ čüčéčĆčāą║čéčāčĆ ą▓ąŠą┤čŗ ąĖ ąĮą░ą╗ąĖčćąĖąĄ čā ąĮąĖčģ ąŠą┐čéąĖč湥čüą║ąŠą╣ ą░ą║čéąĖą▓ąĮąŠčüčéąĖ
ą┐čĆąĖą▓ą╗ąĄč湥ąĮčŗ ą┤ą╗čÅ ąŠą▒čŖčÅčüąĮąĄąĮąĖčÅ ą╝ąĄčģą░ąĮąĖąĘą╝ą░ ą▓ą╗ąĖčÅąĮąĖčÅ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ ąĮą░
菹ĮąĄčĆą│ąĄčéąĖą║čā ą╝ąĄčéą░ą▒ąŠą╗ąĖąĘą╝ą░ čĆą░čüč鹥ąĮąĖą╣.
ąøąĖč鹥čĆą░čéčāčĆą░
1. ą¤ąŠą╗ąĄą▓ąŠą╣ ąÆ. ąÆ. ążąĖąĘąĖąŠą╗ąŠą│ąĖčÅ čĆą░čüč鹥ąĮąĖą╣.
ą£.: ąÆčŗčüčłą░čÅ čłą║ąŠą╗ą░.
1989.
2. Martin Chaplin:
http://www. isbu. ac. uk/water
3. ążąĖąĘąĖč湥čüą║ąĖąĄ
ą▓ąĄą╗ąĖčćąĖąĮčŗ. ąĪą┐čĆą░ą▓ąŠčćąĮąĖą║. ą£., 1991.
4. ąĪą┐čĆą░ą▓ąŠčćąĮąĖą║.
http://www.
eurolab. ru/sprav.
htm
5. LAPWS.
http://www. iapws. org/relguide/surf. pdf 2.
6. ą£ąĖąĘ ąÜ., ąöąČąĄą╣ą╝čü
ąó. ąóąĄąŠčĆąĖčÅ č乊č鹊ą│čĆą░čäąĖč湥čüą║ąŠą│ąŠ ą┐čĆąŠčåąĄčüčüą░. ąø.: ąźąĖą╝ąĖčÅ. 1973
7. ąŁą╣ąĘąĄąĮą▒ąĄčĆą│ ąö.,
ąÜčāčåą╝ą░ąĮ ąÆ. ąĪčéčĆčāą║čéčāčĆą░ ąĖ čüą▓ąŠą╣čüčéą▓ą░ ą▓ąŠą┤čŗ. ąø.: ąōąĖą┤čĆąŠą╝ąĄč鹥ąŠąĖąĘą┤ą░čé. 1975
8.
ąźąŠą╗ą╝ą░ąĮčüą║ąĖą╣ ąÉ. ąĪ., ąĪčéčĆąĄą▒ą║ąŠą▓ ąö. ąĪ. ąŁąĮąĄčĆą│ąĄčéąĖą║ą░ ąĮąŠąŠčüč乥čĆčŗ // ąöąŠą║ą╗ą░ą┤čŗ
ąĀąÉąĪąźąØ. 2004. Ōä¢ 1. ąĪ. 58 ŌĆö 60
9.
ą¢ą▓ąĖčĆą▒ą╗ąĖčü ąÆ. ąĢ. ąÜąŠčüą╝ąŠčäąĖąĘąĖč湥čüą║ąĖąĄ ąĖčüč鹊ą║ąĖ
ą┤ąĖčüąĖą╝ą╝ąĄčéčĆąĖąĖ ąČąĖą▓čŗčģ čüąĖčüč鹥ą╝. ąÆ čüą▒. ą¤čĆąĖąĮčåąĖą┐čŗ čüąĖą╝ą╝ąĄčéčĆąĖąĖ ąĖ
čüąĖčüč鹥ą╝ąĮąŠčüčéąĖ ą▓ čģąĖą╝ąĖąĖ.1987 ą│., 123 ąĪ.
10.
ąĪąĖąĮąĖčåčŗąĮ ąØ. ąś., ą¤ąĄčéčĆąŠčüčÅąĮ ąÆ. ąś., ąüą╗ą║ąĖąĮ ąÆ. ąÉ. ąĖ ą┤čĆ. ą×čüąŠą▒ą░čÅ čĆąŠą╗čī čüąĖčüč鹥ą╝čŗ
"ą╝ąĖą╗ą╗ąĖą╝ąĄčéčĆąŠą▓čŗąĄ ą▓ąŠą╗ąĮčŗ ŌĆö ą▓ąŠą┤ąĮą░čÅ čüčĆąĄą┤ą░" ą▓ ą┐čĆąĖčĆąŠą┤ąĄ // ąæąĖąŠą╝ąĄą┤ąĖčåąĖąĮčüą║ą░čÅ
čĆą░ą┤ąĖąŠčŹą╗ąĄą║čéčĆąŠąĮąĖą║ą░. 1998. Ōä¢ 1. ąĪ. 5 ŌĆō 23
ąÉą▓č鹊čĆąĄč乥čĆą░čé
čüčéą░čéčīąĖ
ą×čüąŠą▒ąĄąĮąĮąŠčüčéąĖ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖą║ąĖ ą▓ąŠą┤čŗ ąĖ ą▒ąĖąŠčŹąĮąĄčĆą│ąĄčéąĖą║ą░
ąÉ. ąĪ. ąźąŠą╗ą╝ą░ąĮčüą║ąĖą╣ (asholman@mtu-net.
ru)
ąÆčüąĄčĆąŠčüčüąĖą╣čüą║ąĖą╣ ąĮą░čāčćąĮąŠ-ąĖčüčüą╗ąĄą┤ąŠą▓ą░č鹥ą╗čīčüą║ąĖą╣
ąĖąĮčüčéąĖčéčāčé 菹╗ąĄą║čéčĆąĖčäąĖą║ą░čåąĖąĖ čüąĄą╗čīčüą║ąŠą│ąŠ
čģąŠąĘčÅą╣čüčéą▓ą░, ą£ąŠčüą║ą▓ą░, ąĀąŠčüčüąĖčÅ
ą¤ąŠą╗čāč湥ąĮčŗ ą╗ąĖąĮąĄą╣ąĮčŗąĄ ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖąĖ
ą░ąĮąŠą╝ą░ą╗čīąĮčŗčģ č鹥ą╝ą┐ąĄčĆą░čéčāčĆąĮčŗčģ ąĘą░ą▓ąĖčüąĖą╝ąŠčüč鹥ą╣ ą┐ą╗ąŠčéąĮąŠčüčéąĖ, č鹥ą┐ą╗ąŠąĄą╝ą║ąŠčüčéąĖ,
čüą║ąŠčĆąŠčüčéąĖ ąĘą▓čāą║ą░ ąĖ čüąČąĖą╝ą░ąĄą╝ąŠčüčéąĖ ą▓ ą┤ąĖą░ą┐ą░ąĘąŠąĮąĄ č鹥ą╝ą┐ąĄčĆą░čéčāčĆ ąŠčé 0 ą┤ąŠ 80ąŠąĪ.
ąśčģ ąŠą┤ąĖąĮą░ą║ąŠą▓čŗą╣ ą▓ąĖą┤ čüą▓ąĖą┤ąĄč鹥ą╗čīčüčéą▓čāčÄčé ąŠą▒ čāąĮąĖą▓ąĄčĆčüą░ą╗čīąĮąŠčüčéąĖ ą╝ąĄčģą░ąĮąĖąĘą╝ą░
ą┐ąĄčĆąĄčüčéčĆąŠą╣ą║ąĖ ąĮą░ą┤ą╝ąŠą╗ąĄą║čāą╗čÅčĆąĮąŠą╣ čüčéčĆčāą║čéčāčĆčŗ ą▓ąŠą┤čŗ, ąŠčéą▓ąĄčćą░čÄčēąĄą│ąŠ ąĘą░ ą░ąĮąŠą╝ą░ą╗ąĖąĖ
ąĄąĄ č鹥čĆą╝ąŠą┤ąĖąĮą░ą╝ąĖč湥čüą║ąĖčģ čüą▓ąŠą╣čüčéą▓. ą¤ąŠą║ą░ąĘą░ąĮą░ ąĘą░ą▓ąĖčüąĖą╝ąŠčüčéčī ąŠą┐čéąĖč湥čüą║ąŠą╣
ą░ą║čéąĖą▓ąĮąŠčüčéąĖ čüą░čģą░čĆą░ ą▓ čĆą░čüčéą▓ąŠčĆąĄ ąČąĄą╗ą░čéąĖąĮčŗ ąŠčé ą║ąĖąĮąĄčéąĖą║ąĖ ą│ąĄą╗ąĄąŠą▒čĆą░ąĘąŠą▓ą░ąĮąĖčÅ ąĖ
č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ. ą×čéčüčāčéčüčéą▓ąĖąĄ ą░ą║čéąĖą▓ą░čåąĖąŠąĮąĮąŠą│ąŠ ą▒ą░čĆčīąĄčĆą░ ą▓ ą┐ąĄčĆąĄčüčéčĆąŠą╣ą║ą░čģ
ą┤ąĖąĮą░ą╝ąĖčćąĮčŗčģ ą║ą╗ą░čüč鹥čĆąĮčŗčģ čüčéčĆčāą║čéčāčĆ ą▓ąŠą┤čŗ ąĖ ąĮą░ą╗ąĖčćąĖąĄ čā ąĮąĖčģ ąŠą┐čéąĖč湥čüą║ąŠą╣
ą░ą║čéąĖą▓ąĮąŠčüčéąĖ ą┐čĆąĖą▓ą╗ąĄč湥ąĮčŗ ą┤ą╗čÅ ąŠą▒čŖčÅčüąĮąĄąĮąĖčÅ ą╝ąĄčģą░ąĮąĖąĘą╝ą░ ą▓ą╗ąĖčÅąĮąĖčÅ č鹥ą╝ą┐ąĄčĆą░čéčāčĆčŗ
ąĮą░ 菹ĮąĄčĆą│ąĄčéąĖą║čā ą╝ąĄčéą░ą▒ąŠą╗ąĖąĘą╝ą░.
ąÜą╗čÄč湥ą▓čŗąĄ čüą╗ąŠą▓ą░: ąÆąŠą┤ą░,
č鹥ą╝ą┐ąĄčĆą░čéčāčĆą░, ą░ąĮąŠą╝ą░ą╗ąĖčÅ, ą║ą╗ą░čüč鹥čĆčŗ, ą░ą┐ą┐čĆąŠą║čüąĖą╝ą░čåąĖčÅ, ą▒ąĄąĘą▒ą░čĆčīąĄčĆąĮąŠčüčéčī,
čģąĖčĆą░ą╗čīąĮąŠčüčéčī, ą▒ąĖąŠčŹąĮąĄčĆą│ąĄčéąĖą║ą░.
ąĪčéčĆą░ąĮąĖčå 5, čĆąĖčüčāąĮą║ąŠą▓ 3, čéą░ą▒ą╗ąĖčå 1.
|